卵殻膜ペプチド
NEM®(酵素分解)
即効性、体感のある新規関節素材
卵殻膜ペプチドNEM®は、機能性成分の宝庫である鶏卵の内外卵殻膜を、酵素分解によりペプチド化することで活性処理されています。過去10年間で8件のヒト臨床試験が実施され、その機能性が確認されています。2019年には、トルコで実施された大規模多施設ヒト臨床RCT試験が、論文に掲載されました。さらに、2009年発売後、北米市場で2億食、その他市場で約3億食が販売されていて、北米の市販後調査で、現在まで問題とすべき副作用の報告がない安心安全素材です。

原料素材の由来・起源について
- ◆15世紀末頃:
日本 野戦の負傷に治癒促進を目的に利用 - ●1596年:
中国 明の薬学書「本草綱目」に「鶏子白皮」として収載 - ◆1607年: 「
本草綱目」が日本に伝来するとともに卵殻膜の利用が広まる - ◆江戸時代以降の日本:*武術の擦り傷に貼付(傷口が治癒した後の細胞に柔軟性がでて、硬くならない)
*美肌の食品や化粧品の原料 *火傷や植皮部部の創傷被覆材、人工臓器および生体材料などの研究対象
公定書情報
中国 明の「本草綱目」に鶏子白皮として収載
成分情報原料情報ページへ
食経験——————–
薬理試験情報
薬理試験①
抗炎症と軟骨保護作用 (ラット)
Mod. Rheumatol. 27: 838 (2017).
| 目 的 | II型コラーゲン惹起関節炎ラットを用いてNEM®の関節の浮腫と炎症性バイオマーカーに与える 影響を検証。さらに膝と足首の病理検査を実施し、軟骨破壊度を評価する。 |
|---|---|
| 試験方法 | ラットにNEM®52 mg/kg 体重/日(ヒト摂取500 mg/日相当量)を2 週間経口投与した後、Ⅱ型コラーゲン 注入により関節炎を惹起させた。さらに17日間NEM®52 mg/kgを経口投与し、健康ラット、関節炎ラット(対照) 関節炎ラット+メトトレキサート75 μg/kg/日投与と効果の比較を行った。 |
| 結 果 |
NEM®は対照と比べて以下の効果が認められた。
|
-
図7. 足首の浮腫の比較 %:阻害率 *P < 0.05 vs 対照 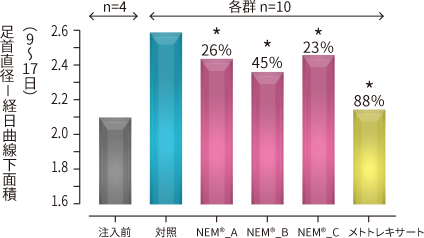
-
図8. 膝関節の病理検査スコアの変化 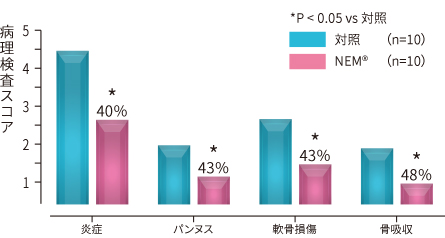
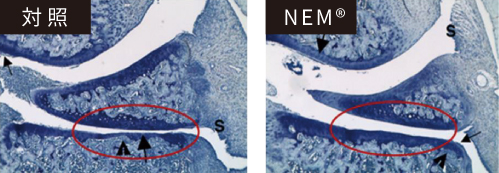
図9.膝関節の顕微鏡画像
対照:軟骨(濃紫色)の破壊と
関節腔(白色)の狭窄と
重篤な炎症(S)が認められる。
薬理試験②
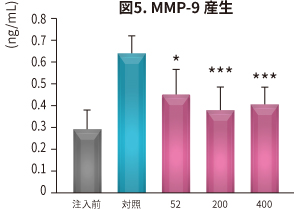
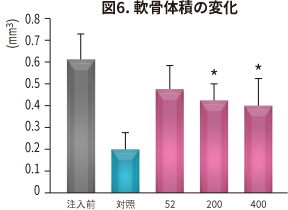
抗炎症、鎮痛、軟骨保護作用 (ラット)
J. Nutr. Health 48: 310 (2015).
| 目 的 | NEM®の関節炎に対する有効性を、ヨード酢酸惹起関節炎ラットを用いて検証。 炎症性バイオマーカーの測定、軟骨の体積測定および軟骨の状態をマイクロCTにより観察 (n=7×5群)。 |
|---|---|
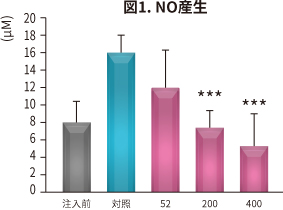
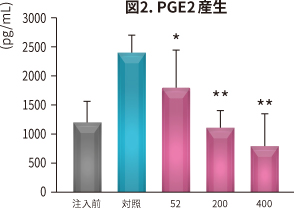
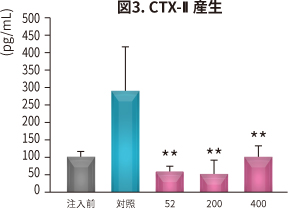
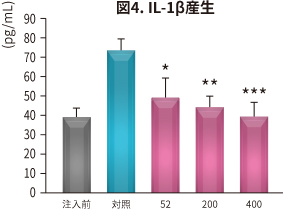
| 試験方法 | ラットにNEM® 52~400 mg/kg 体重/日を6 週間、経口投与。投与開始2 週間後にラットに関節炎を惹起し、NO、PGE2、サイトカイン、MMP、CTX-II、CRP(炎症や細胞破壊で増加するタンパク)の血清中濃度と骨の状態を対照と比較した。 |
| 結 果 |
NEM®は対照と比較して以下の効果が認められた(*P < 0.05 **P < 0.01 ***P < 0.001 vs 対照)。
|
ヒト臨床試験情報
ヒト臨床試験 ①:
変形性関節炎の治療効果の検証
摂取量:500 mg/日
J. Arthritis 8: 4 (2019).
| 目的 | 「変形性膝関節症(OA)に対するNEM®の有効性および安全性」について検証する。 |
|---|---|
| 試験方法 | 二重盲検無作為化プラセボ対照多施設単クロスオーバー試験 |
| 対象 | K/Lグレード2~3のOA患者の男女 166名 40歳以上の者(男性32名、女性134名) |
| 試験期間 | 90日間 ただし、プラセボ群はプラセボ30日間摂取後に、NEM®60日間摂取 |
| 検査項目 | WOMACスコア (疼痛、こわばり、身体機能、総合) |
| 臨床施設 | トルコの8大学および医療センター |
| 試験結果 | 表1.参照 |
| 安全性 | 有害事象の報告件数について、両者の群間に統計的差は認められなかった。 被験者の忍容性は概ね良好、NEM®群では、8件(9.6%)の有害事象の報告があったが、臨床医師によりいずれも重篤ではないと判断された。そのうち、3件は試験との関連性あり、未診断の卵アレルギーによるものと判断された。 |
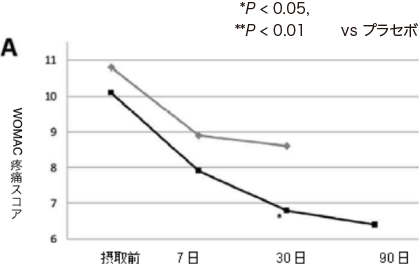
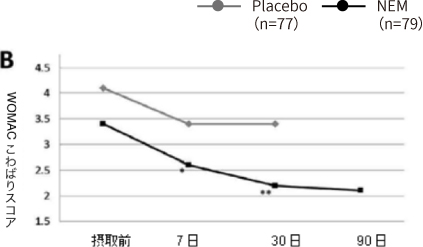
図1:WOMAC疼痛(A)およびこわばり(B)スコア
注:プラセボ群については、30日経過後にNEM®の摂取を開始したので90日時点の結果はなし。
| NEM®摂取期間 | 7日後 | 30日後 | ||
|---|---|---|---|---|
| 対摂取前 | 対プラセボ | 対摂取前 | 対プラセボ | |
| WOMAC 疼痛スコア |
約22%改善 P=0.001 |
有意差なし (図1A「7日」) |
約33%改善 P< 0.001 |
12.3%改善 P=0.023 (図1A「30日」) |
| WOMAC こわばりスコア |
約24%改善 P=0.004 |
有意な改善 P=0.034 (図1B「7日」) |
約35%改善 P< 0.001 |
18.2%改善 P=0.001 (図1B「30日」) |
| WOMAC 身体機能スコア |
15.2%改善 P=0.001 |
|||
| WOMAC 総合スコア |
14.9%改善 P=0.004 |
|||
| 可動域 | 有意差なし | |||
表1:摂取7日後および30日後のWOMACスコア(対摂取前および対プラセボ)
ヒト臨床試験 ②:
予防効果の検証
摂取量:500 mg/日
Clin. Interv. Aging 13: 285 (2018).
| 目 的 | NEM®経口摂取による運動負荷試験に対する関節保護作用の検証。 | ||
|---|---|---|---|
| 試験方法 | プラセボ対照二重盲検試験 | 試験期間 | 2 週間 |
| 対 象 | 膝の痛みが全くない、またはめったに起こらない健常者60 名 | ||
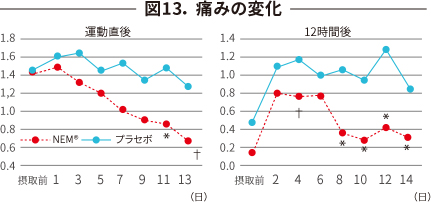
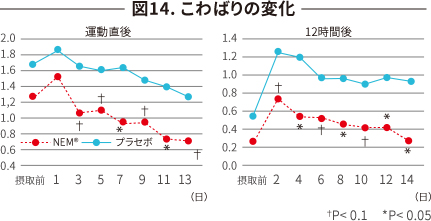
| 検査項目 | 運動負荷試験(毎日の踏み台昇降)を実施し、尿中CTX-II濃度と 運動直後と12 時間後の痛みとこわばりを評価。 |
||
試験結果
| 評 価 | 運動直後 | 運動12 時間後 |
|---|---|---|
| 痛み(図13) | 改善傾向 | 改善 |
| こわばり(図14) | 改善 | 改善 |
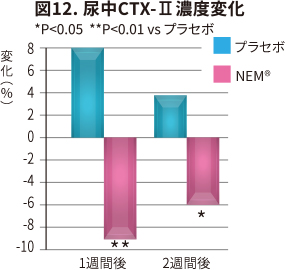
| 尿中CTX-II変化(図12) プラセボとの差 |
摂取1 週間後 -17.2 % |
摂取2 週間後 -9.9 % |
ヒト臨床試験 ③:
変形性関節炎の治療効果の検証
摂取量:500 mg/日
| 対 象 | 膝関節または股関節に変形性関節症が原因の軽度から中程度の痛みがある方 | |
|---|---|---|
| 試験方法 | オープン試験 | |
| 被験者数 期間 |
25 名 / 30 日間 試験完了25 名 | 44 名 / 60 日間 試験完了37 名 |
| 評価回数 | 摂取前、摂取10、30 日後 (計3 回実施) | 摂取前、摂取10、30、60 日後 (計4 回実施) |
| 試験結果 |
|
|
| 副作用の有無 | 試験期間中、重篤な副作用の報告はなく、NEM®の高い安全性と忍容性が確認された。 | |
| 文献 | Int. J. Clin. Med. 7: 169 (2016). | J. Arthritis 3: 136 (2014). |
-
図10. WOMAC スコアの変化 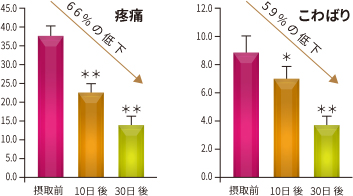
-
図11. 鎮痛薬の使用日数 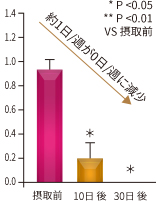
-
表1. 医師と被験者による総合評価 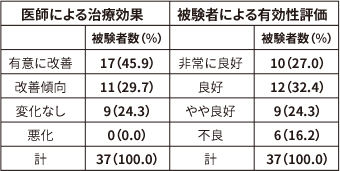
イヌ臨床試験: 関節痛の治療効果の検証
Veterinary Med. Res. Reports 7: 113(2016).
| 試験方法 | 多施設ランダム化二重盲検プラセボ対照試験 |
|---|---|
| 対 象 | 走歩行困難が認められるイヌ51 頭 (試験完了42 頭) |
| 試験食品 | NEM®群…NEM®13.5 mg/kg/日(ヒト摂取500 mg/日 相当量) プラセボ群…賦形剤 経口投与 |
| 試験期間 | 6 週間 |
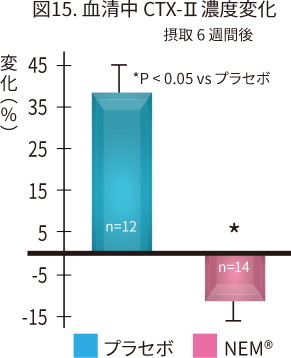
| 評 価 | イヌ簡易疼痛評価(CBPI)、走歩行時の困難度評価(VCSA)、 血清中CTX-II濃度 |
| 結 果 |
NEM®群はプラセボ群と比較して以下の効果が認められた。
|
安全性情報
1. 安全性試験の結果を公表
Food Chem. Toxicol. 50: 604 (2012).
- * 細胞毒性:
ヒト由来上皮細胞 陰性 - * 遺伝毒性:
Ames 試験 陰性 - * 急性毒性:
ラットLD50>2 g/㎏ - * 亜慢性毒性(90日):
ラット 0.4 g、2 g/㎏(ヒト推奨量 500 mg/日の約10倍、50倍相当)で安全性を確認
2. 5 億食の販売実績と市販後調査:上市後10 年間以上経過、卵アレルギー以外の健康被害の報告なし
品質規格情報原料情報ページへ
安定性情報——————–
製品事例OEM製品一覧ページへ